Návrh zákona o zdravotnických prostředcích [ZoZP] byl na začátku ledna 2020 schválen vládou a v nejbližších dnech jej čeká první čtení v poslanecké sněmovně. Jaké konkrétní změny přinese zákon o zdravotnických prostředcích výrobcům, distributorům, dovozcům i osobám provádějícím jejich servis?
„Očekávaná účinnost v případě hladkého průběhu legislativního procesu je 1. června 2020,“ říká Jakub Král ze společnosti Porta Medica, který se podílel na přípravě zákona, a který shrnul nejdůležitější změny, které nová legislativa přinese. Upozorňuje přitom i na to, že text zákona se může ještě změnit v průběhu legislativního procesu.
Předmět úpravy [§ 1]
Zákon o zdravotnických prostředcích [ZoZP] doplňuje Nařízení 2017/745 o zdravotnických prostředcích [MDR], upravuje oblasti ponechané v gesci národních zákonodárců [oblast předepisování, výdeje, používání, BTK a oprav či lokální registrace osob a ZP] a stanovuje sankce za porušení MDR a tohoto ZoZP.
Informační systém ZP [§ 7]
Ustanovení § 7 ZoZP počítá se zřízením Informačního systému zdravotnických prostředků [ISZP], který nahradí stávající Registr zdravotnických prostředků [RZPRO]. Bude sloužit např. k plnění ohlašovacích povinností distributorů a servisních organizací či k podání žádosti o vydání certifikátu volného prodeje [FSC – Free Sale Certificate]. Tento systém by měl být nicméně spuštěn až cca po dvou a půl letech od účinnosti ZoZP [blíže viz část věnovaná registracím a notifikacím].
Povinnosti výrobců [§ 8]
Zákon o zdravotnických prostředcích nově upravuje některé povinnosti výrobců. Jako příklad lze uvést povinnost přeložit prohlášení o shodě do českého jazyka v případě prostředku dodávaného na trh na území ČR. Výrobce, popřípadě jeho zplnomocněný zástupce, je dále povinen předložit Státnímu ústavu pro kontrolu léčiv [SÚKL] na požádání všechny informace a dokumentaci nezbytné k prokázání shody prostředku [v zásadě tedy celou technickou dokumentaci] v českém, slovenském nebo anglickém jazyce, pokud má v ČR sídlo, nebo pokud prostředek na trh na území ČR uvádí či dodává. Obnova jednorázových ZP [§ 9] MDR ponechalo na členských státech, zda na svém území umožní obnovu jednorázových prostředků. ZoZP tuto možnost zcela vylučuje [nebude možno na území ČR provádět činnost obnovy, ani obnovené jednorázové prostředky dovážet ze zahraničí a používat je na území České republiky].
Klinická hodnocení [§ 11 – 22]
Oblast klinického hodnocení je upravena především v MDR, Zákon o zdravotnických prostředcích však nově poměrně detailně upravuje činnost etických komisí. Novinkou, kterou přináší ZoZP, je například šedesátidenní lhůta pro vydání stanoviska etické komise [poté platí fikce pozitivního stanoviska].
Zákon o zdravotnických prostředcích obsahuje velmi přísná přechodná ustanovení týkající se klinických zkoušek. Pokud v řízeních o povolení klinické zkoušky zahájených podle zákona č.268/2014 Sb. nebude rozhodnuto do účinnosti ZoZP, budou tato řízení zastavena. Povolené, ale do účinnosti ZoZP nezahájené klinické zkoušky, budou považovány za nepovolené. Kontroly probíhajících klinických zkoušek zahájených přede dnem nabytí účinnosti ZoZP se dokončí podle zákona č. 268/2014 Sb. Do doby plné funkčnosti modulu klinických zkoušek v databázi EUDAMED se pro hlášení závažných nepříznivých událostí a žádostí o povolení klinických zkoušek použijí stávající právní předpisy. Pro evidenci klinických zkoušek a podávání žádostí o provedení změn v klinických zkouškách povolených podle zákona č.268/2014 Sb. se použije RZPRO.
Registrace a notifikace
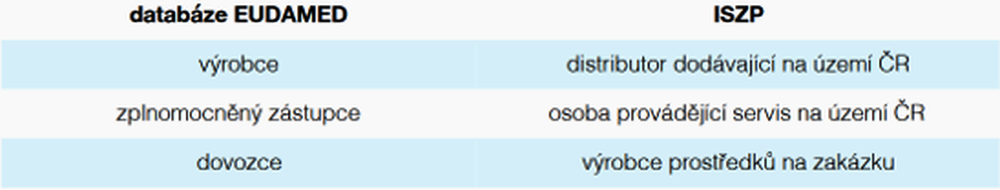
MDR sjednocuje napříč členskými státy registrační povinnosti výrobců, zplnomocněných zástupců a dovozců. Tyto osoby by měly nově plnit tyto povinnosti prostřednictvím celoevropské databáze EUDAMED [která bude veřejně přístupná]. Nicméně Evropská komise před nedávnem oficiálně oznámila, že spuštění databáze EUDAMED bude nutné o dva roky odložit. Předpokládané spuštění databáze je tedy nyní stanoveno na květen 2022, a to jak pro obecné ZP, tak pro IVD. Do plné funkčnosti modulu osob a prostředků v databázi EUDAMED budou shora uvedené osoby ohlašovat svou činnost a notifikovat prostředky podle zákona č.268/2014 Sb., to znamená prostřednictvím RZPRO [viz § 70 ZoZP].
V souladu s MDR mohou členské státy ponechat v platnosti. Popřípadě přijmout vnitrostátní předpisy týkající se registrace distributorů prostředků, které byly na jejich území dodány. Jak již bylo uvedeno výše, k těmto lokálním registracím bude sloužit ISZP. Prostřednictvím ISZP budou své ohlašovací povinnosti dále plnit osoby provádějící servis prostředků a výrobci prostředků na zakázku. Pokud uvedené osoby řádně ohlásily svou činnost podle zákona č.268/2014 Sb. přede dnem nabytí účinnosti ZoZP, budou se považovat za osoby se splněnou ohlašovací povinností podle ZoZP.
SÚKLu je dána povinnost zajistit migraci dat z RZPRO do ISZP. Lhůta ke zřízení ISZP je přechodnými ustanoveními ZoZP navázána na spuštění databáze EUDAMED. Dle §69 bude ISZP zřízen nejpozději do 18 měsíců. A to ode dne účinnosti ZoZP, nebo do 6 měsíců ode dne spuštění databáze EUDAMED. To podle toho, co nastane později. S ohledem na dvouletý odklad spuštění databáze EUDAMED lze tedy s největší pravděpodobností předpokládat, že by ISZP měl být spuštěn do listopadu 2022.
Způsob registrace po nabytí účinnosti ZOZP listopadu 2022
Ohlašování distributorů a osob na servis [§ 23 – 25]
Distributoři a osoby provádějící servis budou povinni SÚKLu oznámit svou činnost před zahájením této činnosti, a to prostřednictvím ISZP. Do doby spuštění ISZP se povinnosti uložené v § 23 – 25 ZoZP budou plnit prostřednictvím RZPRO. Obdobně jako stávající zákon č. 268/2014 Sb., i ZoZP zavádí výjimku z ohlašovací povinnosti pro distributory, kteří dodávají výhradně prostředky rizikové třídy I. Ohlašovat se i nadále nebudou muset ani výdejci a prodávající [tj. osoby, které dodávají prostředky výhradně spotřebitelům], přestože jsou podle terminologie MDR rovněž považováni za distributory. Zcela nově je stanovena legální výjimka z ohlašovací povinnosti pro osoby provádějící servis výhradně prostředků rizikové třídy I.
Distributoři: Nebudou již vyžadovány samostatné notifikace prostředků, nicméně v rámci registrace činnosti budou vyplněny základní údaje o prostředcích [určený účel a základní UDI-DI, až bude k dispozici – do té doby jen obchodní název a GMDN kód], kteří distributoři zamýšlí dodat na území ČR [s výjimkou ZP rizikové třídy I].
Osoby provádějící servis prostředků: Nově bude třeba vyplnit jedinečné registrační číslo výrobců prostředků, pro které osoba zamýšlí servis provádět, které bude výrobci přiděleno při registraci v databázi EUDAMED. Dále bude přikládán doklad o proškolení výrobce, zplnomocněného zástupce či osoby pověřené [pokud nebude servis prováděn přímo výrobcem].
Jak to bude s tzv. legacy devices: Výše zmíněné povinnosti se vztahují pouze na prostředky uvedené již podle nařízení MDR. Dle přechodných ustanovení se v případě prostředků uvedených na trh dle směrnice 93/42/EHS [MDD] bude až do konce platnosti certifikátu [nejpozději však do května 2024] postupováno podle zákona č.268/2014 Sb., tedy stejně jako doposud [tedy budou se registrovat a notifikovat prostřednictvím RZPRO].
Správná skladovací praxe [§ 27]
Zákon o zdravotnických prostředích zavádí termín správná skladovací praxe. Tento termín nahradí stávající pojem správná dovozní a distribuční praxe. Stávající termín byl poněkud zavádějící s ohledem na skutečnost, že povinnost dodržovat pravidla správné dovozní a distribuční praxe platila nejen pro dovoze a distributory, ale přiměřeně též pro výdejce, prodávající a poskytovatele zdravotních služeb. Nyní tedy dochází k terminologickému zpřesnění, okruh povinných subjektů zůstává stejný. Podrobná pravidla stanoví prováděcí právní předpis, lze však očekávat, že budou obsahově podobná těm, která jsou nyní ve vyhlášce č. 62/2015 Sb.
Předepisování [§ 28]
Nově bude moci vybrané prostředky předepsat nejen lékař či zubní lékař, ale i jiný zdravotnický pracovník [např. zdravotní sestra], a to v souladu s přílohou č. 3 zákona č. 48/1997 Sb. [aktuálně se připravuje novela, která stanoví, preskripce jakých prostředků bude svěřena do rukou jiných zdravotnických pracovníků]. Platnost poukazu se zkrátí ze stávajících 90 na 30 dní [v případě potřeby však může předepisující platnost poukazu prodloužit, a to až na 1 rok]. Prostředek na poukaz vystavený přede dnem účinnosti ZoZP bude možno vydat podle zákona č. 268/2014 Sb.
Výdej [§ 29 – 34]
V oblasti výdeje došlo ke dvěma zásadním změnám. Na jedné straně je upuštěno od požadavku na odborné vzdělání u osoby provádějící výdej zdravotnických prostředků rizikové třídy I [tyto ZP bude nově moci vydat kdokoliv]. Na druhou stranu dochází ke zpřísnění v oblasti zásilkového výdeje. Doposud platila povinnost zajistit v provozní době informační službu, kterou bude poskytovat osoba s požadovaným vzděláním [farmaceut, farmaceutický asistent atd.]. Nově však požadavky na vzdělání musí splňovat všechny osoby provádějící zásilkový výdej, přičemž nabízení prostředků a přijímání objednávek od zákazníků bude považováno za součást zásilkového výdeje. Cílem této nové právní úpravy je zamezit případům obcházení zákona.
Karta o implantátu [§ 37]
Nově je v souladu s MDR stanovena povinnost poskytnout pacientovi či jeho zákonnému zástupci kartu s informacemi o implantátu. Tyto informace musí být v českém jazyce.
Instruktáž [§ 38]
V oblasti instruktáží došlo k určitým úlevám pro poskytovatele zdravotních služeb. Již není plošně vyžadováno provedení instruktáže u všech prostředků rizikové třídy IIb a III. Instruktáže budou povinné pouze v případě, že tak stanoví výrobce v návodu k použití. Rovněž došlo k rozšíření okruhu osob, které mohou instruktáže vykonávat. V případě zániku výrobce bude možno nahradit poučení výrobcem poučením osobou, která má v používání daného typu prostředku nejméně tříletou praxi.
Servis [§ 41 – 43]
Zákon o zdravotnických prostředcích nově definuje požadavky na vzdělání a praxi osob provádějících servis [BTK a opravy]. Dochází tím k odstranění nelogičnosti, kterou lze nalézt v současném zákoně č. 268/2014 Sb., kdy je požadavek na délku odborné praxe delší u osob s odborným vzděláním než u osob bez vzdělání. Nově jsou požadavky týkající se vzdělání a praxe kladeny pouze na osoby provádějící servis aktivních prostředků rizikových tříd IIa, IIb a III. A to odstupňovaně právě podle druhu dosaženého vzdělání. Osoba, která bude mít ke dni účinnosti ZoZP alespoň roční praxi v oblasti BTK či oprav, bude považována za osobu splňující požadavek na odborné vzdělání. U všech prostředků zůstává stěžejní požadavek na proškolení. Přičemž stejně jako u instruktáží se rozšiřuje okruh osob, které toto proškolení mohou provést. V případě zániku výrobce bude moci školení provádět osoba, která má nejméně pětiletou praxi v provádění servisu daného typu prostředku.
Vigilance [§ 45 – 47]
Oblast vigilance je obdobně jako oblast klinického hodnocení upravena převážně v MDR. V této souvislosti je třeba upozornit na skutečnost, že dochází ke změně definice nežádoucí příhody. ZoZP je zaměřen převážně na evidenci závažných nežádoucích příhod, k nimž došlo na území ČR a na FSCA. A které mají být na území ČR provedeny. Nově je upraveno tzv. hlášení trendu. Zajímavostí je, že MDR ani ZoZP neukládá poskytovatelům zdravotních služeb povinnost hlásit podezření na nežádoucí příhodu. Nýbrž pouze povinnost minimalizovat dopady, a dále povinnosti evidence a součinnosti. Šetření nežádoucí příhody a monitorování provádění FSCA oznámených SÚKLu v souladu s dosavadními právními předpisy se dokončí podle současného znění zákona č. 268/2014 Sb.
Přestupky [§ 50 – 60]
Zákon o zdravotnických prostředcích ukládá sankce za porušení ustanovení ZoZP i MDR. Nejvyšší možná pokuta, kterou bude SÚKL oprávněn uložit, bude 30 000 000 Kč.
Povolování výjimek [§ 61]
Článek 59 MDR stanoví, že příslušný orgán může povolit na území daného členského státu uvedení na trh nebo do provozu pro konkrétní zdravotnický prostředek. A to u prostředku, u kterého nebyly provedeny postupy posuzování shody, ale jehož použití je v zájmu ochrany veřejného zdraví nebo bezpečnosti či zdraví pacientů. V případě použití zdravotnického prostředku u jediného pacienta, může o povolení výjimky rozhodnout MZ ČR. Pokud je to v zájmu tohoto pacienta a na trhu není odpovídající alternativa. ZoZP nově umožňuje udělení výjimky i pro použití konkrétního zdravotnického prostředku pro blíže nedefinovanou skupinu pacientů. Tato kompetence je svěřena SÚKL.
Přechodná ustanovení [§ 65 – 70]
Přechodná ustanovení řeší zdravotnické prostředky uvedené na trh v souladu s předchozími právními předpisy a osoby ohlášené v souladu s předchozím zákonem č. 268/2014 Sb. Právní vztahy, na které se v souladu s MDR použijí ustanovení MDD nebo AIMDD, se řídí dosavadními právními předpisy. Tedy jak zákonem č. 268/2014 Sb. v současném znění, tak i prováděcími právními předpisy [nařízení vlády a vyhlášky].
–RED–